MINI APSKATS
Priekšpostenis pret vēzi: universāli tikai vēža marķieri
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, Shanghai 200233, Ķīna;2 Harbinas Medicīnas universitātes Pirmās saistītās slimnīcas Vispārējās ķirurģijas nodaļa, Harbina 150001, Ķīna;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, Ķīna;4 Ningxia Hui autonomā reģiona Tautas slimnīca, Ningsijas Medicīnas universitāte, Yinchuan 750002, Ķīna;5 Šanhajas Sabiedrības veselības klīniskais centrs un Vispārējās ķirurģijas nodaļa, Huašaņas slimnīca un vēža metastāžu institūts un RNS epiģenētikas laboratorija, Biomedicīnas zinātņu institūti, Šanhajas Medicīnas koledža, Fudanas Universitāte, Šanhaja 200032, Ķīna
KOPSAVILKUMS
Vēzis ir galvenais nāves cēlonis visā pasaulē.Agrīna vēža atklāšana var samazināt visu veidu vēža mirstību;tomēr vairumam vēža veidu trūkst efektīvu agrīnas noteikšanas biomarķieru.DNS metilēšana vienmēr ir bijusi galvenais intereses mērķis, jo DNS metilēšana parasti notiek pirms citām nosakāmām ģenētiskām izmaiņām.Pētot vēža kopīgās pazīmes, izmantojot jaunu vadotnes pozicionēšanas secību DNS metilēšanai, virkne universālu tikai vēža marķieru (UCOM) ir parādījušies kā spēcīgi kandidāti efektīvai un precīzai vēža agrīnai noteikšanai.Kamēr pašreizējo vēža biomarķieru klīnisko vērtību samazina zemā jutība un/vai zemā specifika, UCOM unikālās īpašības nodrošina klīniski nozīmīgus rezultātus.UCOM klīniskā potenciāla apstiprināšana plaušu, dzemdes kakla, endometrija un urotēlija vēža gadījumā vēl vairāk atbalsta UCOM izmantošanu vairākos vēža veidos un dažādos klīniskos scenārijos.Faktiski pašlaik tiek aktīvi izmeklēti UCOM pielietojumi, veicot turpmāku novērtēšanu attiecībā uz vēža agrīnu atklāšanu, palīgdiagnozi, ārstēšanas efektivitāti un recidīvu uzraudzību.Molekulārie mehānismi, ar kuriem UCOM atklāj vēzi, ir nākamās svarīgās tēmas, kas jāizpēta.UCOM izmantošanai reālos scenārijos arī nepieciešama ieviešana un uzlabošana.
ATSLĒGVĀRDI
Vēža noteikšana;vēža skrīnings;DNS metilēšana;vēža epigenētika;vēža biomarķieri
Kāpēc mums steidzami nepieciešams jauns biomarķieri?
Pēc vairāk nekā gadsimtu ilgas cīņas ar vēzi vēzis joprojām ir visnāvējošākais bioloģiskais drauds cilvēcei.Vēzis joprojām ir globāla veselības problēma, un 2020. gadā tiek lēsts, ka 19,3 miljoni jaunu saslimšanas gadījumu un gandrīz 10 miljoni nāves gadījumu1. 2020. gadā Ķīnā tika diagnosticēti aptuveni 4,6 miljoni jaunu vēža gadījumu, kas veido 23,7% no visiem jaunajiem vēža gadījumiem pasaulē saskaņā ar GLOBOCAN1.Turklāt 2020. gadā Ķīnā ar vēzi tika saistīti aptuveni 3 miljoni nāves gadījumu, kas bija 30% no globālajiem ar vēzi saistīto nāves gadījumu1.Šī statistika liecina, ka Ķīna ir pirmajā vietā vēža sastopamības un mirstības rādītājā.Turklāt 5 gadu vēža izdzīvošanas rādītājs ir 40,5%, kas ir 1,5 reizes zemāks nekā 5 gadu izdzīvošanas rādītājs Amerikas Savienotajās Valstīs2,3.Salīdzinoši zemāka izdzīvošana un augstāks mirstības līmenis Ķīnā nekā valstīs ar augstākiem tautas attīstības indeksiem liecina, ka steidzami ir nepieciešama efektīva un rentabla vēža profilakses un uzraudzības sistēma.Agrīna vēža atklāšana ir viens no svarīgākajiem veselības aprūpes sistēmas elementiem.Agrīna vēža atklāšana var uzlabot prognozi un izdzīvošanu agrīnā stadijā gandrīz visiem vēža veidiem4.Veiksmīgas skrīninga stratēģijas ir izraisījušas ievērojamu dzemdes kakla, krūts, kolorektālā un prostatas vēža sastopamības un mirstības samazināšanos.
Tomēr agrīna vēža atklāšana nav viegls uzdevums.Agrīna vēža bioloģijas un prognozes izpēte, uzticamu agrīnas noteikšanas biomarķieru noteikšana un apstiprināšana, kā arī pieejamu un precīzu agrīnas noteikšanas tehnoloģiju izstrāde vienmēr ir bijuši lielākie šķēršļi šajā procesā4.Precīza vēža noteikšana var atšķirt labdabīgus bojājumus no ļaundabīgiem, kas palīdz izvairīties no nevajadzīgām procedūrām un atvieglo turpmāku slimības pārvaldību.Pašreizējās agrīnās noteikšanas stratēģijas ietver uz endoskopu balstītas biopsijas, medicīnisko attēlveidošanu, citoloģiju, imūntestus un biomarķieru testus5–7.Tā kā uz endoskopu balstītas biopsijas ir uzmācīgas un dārgas, tām ir raksturīgs smags slogs, jo tā ir liela medicīniska procedūra, kuras pamatā ir profesionāls personāls.Tāpat kā citoloģija, abas skrīninga metodes ir atkarīgas no medicīnas profesionāļiem un ir balstītas uz personisku spriedumu ar veiktspēju, kas ir tālu no ideāla8.Turpretim imūntesti ir ļoti neprecīzi, ņemot vērā augsto viltus pozitīvo rezultātu līmeni.Medicīniskajai attēlveidošanai kā skrīninga taktikai ir nepieciešams dārgs aprīkojums un specializēti tehniķi.Tādējādi medicīniskā attēlveidošana ir ļoti ierobežota zemās pieejamības dēļ.Visu šo iemeslu dēļ biomarķieri šķiet labāks risinājums agrīnai vēža noteikšanai.
Sarakste ar: Yinshan Li un Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ORCID ID: https://orcid.org/0009-0005-3340-6802 un
https://orcid.org/0000-0001-9920-1133
Saņemts 2023. gada 22. augustā;pieņemts 2023. gada 12. oktobrī;
publicēts tiešsaistē 2023. gada 28. novembrī.
Pieejams www.cancerbiomed.org
©2023 Vēža bioloģija un medicīna.Creative Commons
Attiecinājums — nekomerciāla 4.0 starptautiskā licence
Biomarķieri pašlaik tiek klasificēti kā proteīni, DNS mutāciju marķieri, epiģenētiskie marķieri, hromosomu anomālijas, RNS marķieri, kas iegūti tieši no audzējiem, vai audzēja fragmenti, kas iegūti netieši no ķermeņa šķidrumiem.Olbaltumvielu marķieri ir visplašāk izmantotie biomarķieri vēža skrīningā un diagnostikā.Olbaltumvielu biomarķierus kā skrīninga biomarķierus ierobežo tendence tikt ietekmētiem labdabīgiem bojājumiem, kas izraisa pārmērīgu diagnozi un pārmērīgu ārstēšanu, kā ziņots par α-fetoproteīnu un prostatas specifisko antigēnu (PSA)9,10.RNS marķieri ietver ģenētiskās ekspresijas modeļus un citus nekodējošus RNS marķierus. Ģenētiskās ekspresijas RNS marķieru kombināciju var noteikt, izmantojot urīna paraugus, kuru jutīgums bija tālu no apmierinošas (60%) attiecībā uz primārajiem audzējiem un kuru noteikšana var var ietekmēt RNS viegli sadalīšanās raksturs normālā vidē11.Gan ģenētiskie, gan epiģenētiskie marķieri saskaras ar audzēju izplatības problēmu un ierobežošanu ar vēža veidiem.
DNS metilēšana ir bijusi spēcīga kandidāte kā agrīnas noteikšanas biomarķieris kopš Feinberga 1983. gadā, kad to pirmo reizi saistīja ar vēzi12. DNS metilēšanas aberācijas tiek novērotas visās vēža stadijās, jau pirmsvēža stadijā.Aberrantā DNS hipermetilācija parasti notiek CpG salās gēnu promotoros, lai neitralizētu audzēja nomācējus13, 14.Pētījumi arī liecina, ka patoloģiska DNS hipermetilācija ir saistīta ar attīstības regulatoru regulēšanu15.DNS metilēšanas ieleja, kas parasti ir saistīta ar attīstības regulatoriem un hipermetilētiem vēža veidiem, var pārslēgt gēnu ekspresijas režīmu uz stabilāku no DNS metilēšanas atkarīgu režīmu un samazināt savienojumu ar metilētu histonu H3K27me3 un saistītajiem polikomba proteīniem16, 17.
Starp daudzajiem publicētajiem DNS metilēšanas marķieriem vairāki ir veiksmīgi debitējuši tirgū;tomēr pašreizējiem komercializētajiem DNS metilēšanas marķieriem un diagnostikas paneļiem vēl nav pilnībā jāatspoguļo vēža agrīnas noteikšanas potenciāls vairāku iemeslu dēļ18.Lai gan lielākoties uzrāda pieņemamu veiktspēju, izmantojot datu bāzes informāciju, šie biomarķieri parasti darbojas mazāk ideāli reālajā pasaulē, jo reālās pasaules paraugi bieži ir sarežģītāki un nav tik reprezentatīvi kā tie, kas atlasīti datu bāzēs.Ir pierādīts, ka uz nākamās paaudzes sekvencēšanu balstītai vairāku vēža metilēšanas agrīnai noteikšanai I un II stadijas vēža gadījumā ir tikai 16, 8% un 40, 4% jutība19.Agrīnas noteikšanas testiem nepieciešama lielāka stabilitāte un precīzāki biomarķieri.
Universālā vēža marķiera (UCOM) atklāšana, izmantojot virzošās pozicionēšanas sekvencēšanu (GPS)
Neskatoties uz gadu desmitiem ilgušajiem vēža pētījumiem, apmierinoša profilakse un ārstēšana nav īstenota.Ir vajadzīgas jaunas metodoloģijas, lai pētnieki varētu rūpīgi novērtēt vēzi.Pēdējo 23 gadu laikā 6 vēža pazīmes, piemēram, izvairīšanās no apoptozes, audu invāzijas un metastāzēm utt., Ir paplašinātas līdz 14, iekļaujot tādas funkcijas kā nemutācijas epiģenētiskā pārprogrammēšana un polimorfie mikrobiomi 20, 21.Tā kā tiek atklāta sīkāka informācija par vēzi, vēža pētniecībā tiek ieviestas plašākas perspektīvas.Vēža pētījumi pamazām ir nonākuši jaunākā laikmetā divos virzienos (kopīgums un individualitāte).Pēdējos gados attīstoties precīzajai onkoloģijai, vēža izpētes uzmanības centrā ir individualizēta mērķterapija un vēža neviendabība22.Tādējādi nesen identificētie vēža biomarķieri galvenokārt ir vērsti uz konkrētiem vēža veidiem, piemēram, PAX6 dzemdes kakla vēzi23 un BMP3 kolorektālajam vēzim24.Šo vēža veidiem raksturīgo biomarķieru veiktspēja ir atšķirīga, taču uzņēmīgiem indivīdiem joprojām nav iespējams vienlaikus veikt visu vēža veidu skrīningu bioloģisko paraugu iegūšanas ierobežojumu un augsto izmaksu dēļ.Būtu ideāli, ja mēs varētu identificēt vienu, stabilu biomarķieri, kas ir efektīvs visiem vēža veidiem agrīnā stadijā.
Lai sasniegtu šādu ideālu mērķi, no potenciālo biomarķieru tipu saraksta ir jāizvēlas labāks biomarķiera kandidāts.Ir zināms, ka DNS metilēšanas aberācijas starp visiem ģenētiskajiem un epiģenētiskajiem profiliem ir saistītas ar vēzi un ir dažas no agrākajām, ja ne pirmās, ar vēzi saistītām novirzēm, kas rodas hronoloģiski.DNS metilēšanas izpēte tika uzsākta agri, taču to kavēja pētījumu metožu trūkums.Starp 28 miljoniem potenciālo metilēto CpG vietu genomā ir jāatklāj pārvaldāms skaits un jāsaskaņo ar genomu, lai labāk izprastu audzēja ģenēzi.Visa genoma bisulfīta sekvencēšana (WGBS), kas tiek uzskatīta par DNS metilēšanas sekvencēšanas zelta standartu, var aptvert tikai 50% Cs vēža šūnās, jo tiek veikta bisulfīta terapija, kas sadala DNS fragmentus un samazina genoma sarežģītību. Cs-transformācija uz-Ts25.Citas metodes, piemēram, 450k mikroshēmas, aptver tikai 1,6% genoma metilēšanas.Pamatojoties uz 450 000 datiem, DNS metilēšanas noteikšanas panelim ir 35,4% jutība pret 6 I stadijas vēža veidiem26.Vēža veidu ierobežojumi, slikta veiktspēja un noteikšanas metožu radītais troksnis analītiskajā procesā ir kļuvuši par lielākajiem šķēršļiem vēža noteikšanas paneļiem.
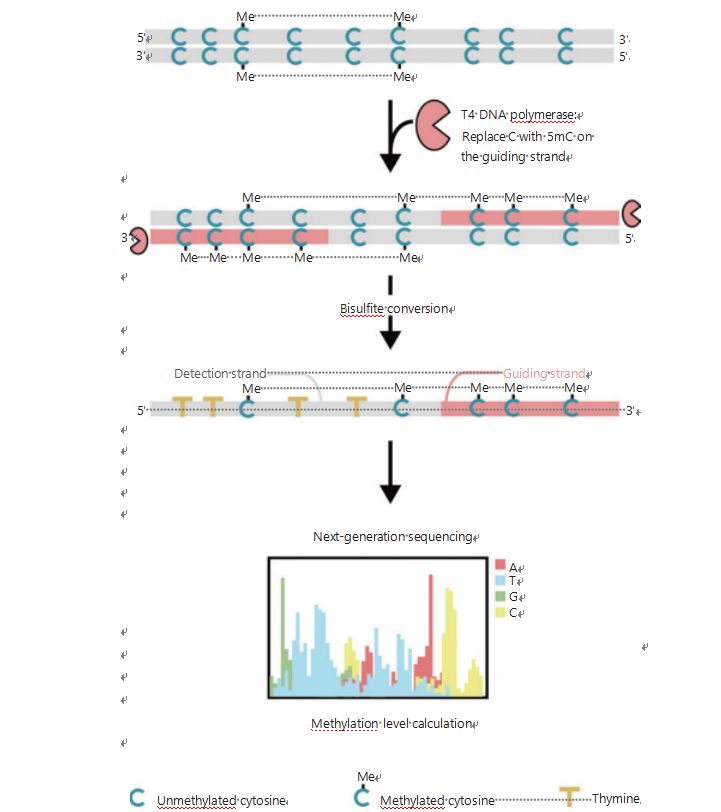
Lai labāk izpētītu šūnu epiģenētiskos modeļus audzēja ģenēzes un metastāžu laikā, mēs izstrādājām unikālu GPS genoma mēroga DNS metilēšanas noteikšanai, kas aptver līdz 96% CpG vietu 0, 4 miljardu lasījumu laikā25.GPS ir divpusēja sekvencēšanas metode, kurā pēc bisulfīta apstrādes tiek izmantots nekonvertējamu metilcitozīnu DNS fragments 3′ galā, kas vada DNS metilēšanas aprēķinu 5′ galam, izmantojot pāra galu sekvencēšanu (1. attēls)25.Metilcitozīna vadošā virkne, kas darbojas kā veidnes virkne, palīdz augsta GC reģiona izlīdzināšanā, kas atgūst visvairāk pamestos sekvencēšanas datus tradicionālajā WGBS.GPS augstā pārklājuma funkcija nodrošina milzīgu daudzumu DNS metilēšanas informācijas, kas ļauj mums izpētīt vēža metilēšanas profilus ar ievērojami augstāku izšķirtspēju iepriekš nepietiekami pētītajos reģionos.
GPS nodrošina mūs ar jaudīgu rīku vēža viendabīguma izpētei, kas var ievērojami vienkāršot vēža izpēti un, iespējams, atrast universālu audzēju un metastāžu skaidrojumu.Analizējot vēža šūnu līniju GPS datus, bieži tika sastapta unikāla parādība.Bija vairāki reģioni, kas vairāku veidu vēža paraugos bija neparasti hipermetilēti.Šis negaidītais atklājums vēlāk tika apstiprināts, lai kalpotu kā UCOM.Ir analizēti vairāk nekā 7000 paraugu no 17 vēža veidiem Cancer Genome Atlas (TCGA) datu bāzē, starp kuriem mēs identificējām pirmo UCOM, HIST1H4F, ar histonu saistītu gēnu, kas ir hipermetilēts visu veidu vēža gadījumā27.Pēc tam TCGA datubāzē, Gene Expression Omnibus (GEO) datubāzē un reālās pasaules klīniskajos paraugos tika atrasta un apstiprināta virkne UCOM.Šobrīd HIST1H4F, PCDHGB7 un SIX6 ir atrasti un apstiprināti kā UCOM.Negaidītais UCOM atklājums sniedz spēcīgu atbildi uz nepieciešamību agrīni atklāt vēzi.UCOM nodrošina risinājumu vairāku vēža veidu viena marķiera noteikšanai.
UCOM raksturojums
Pēc apstiprināšanas tika pierādīts, ka UCOM ir četras galvenās īpašības, kas ļauj UCOM pārspēt pašreizējo biomarķieru efektivitāti (2. attēls).
Unikāls ļaundabīgajiem audzējiem
UCOM ir unikāli vēža vai pirmsvēža bojājumiem, un tos neietekmē normālas fizioloģiskas izmaiņas.Daži no pašreizējiem ar vēzi saistītajiem marķieriem, kas ir plaši izmantoti agrīnā atklāšanā un/vai skrīningā, ir izraisījuši pārmērīgu diagnozi.Paaugstināts PSA līmenis, klīniski akreditēts skrīninga instruments, tiek konstatēts arī labdabīgos stāvokļos, piemēram, prostatas hiperplāzijā un prostatītā10.Pārmērīga diagnoze un no tā izrietošā pārmērīga ārstēšana samazina dzīves kvalitāti zarnu, urīnceļu un seksuālu komplikāciju dēļ28.Citi uz olbaltumvielām balstīti un klīniskajā vidē plaši izmantoti biomarķieri, piemēram, CA-125, nav devuši nozīmīgus ieguvumus, vienlaikus veicot pārmērīgu diagnozi un pārmērīgu ārstēšanu29.Augstā UCOM specifika ļaundabīgiem audzējiem novērš šos trūkumus.UCOM, PCDHGB7, efektīvi atšķir augstas pakāpes plakanšūnu intraepiteliālus bojājumus (HSIL) un dzemdes kakla vēzi no normāliem paraugiem un zemas pakāpes plakanšūnu intraepiteliālajiem bojājumiem (LSIL), savukārt lielākā daļa citu biomarķieru var atšķirt tikai dzemdes kakla vēzi no normāliem paraugiem30.Lai gan PCDHGB7 nenosaka būtiskas atšķirības starp normālu endometriju un endometrija hiperplāziju, tiek konstatētas būtiskas atšķirības starp normālu endometriju un netipisku hiperplāziju, un vēl lielākas atšķirības tiek atklātas starp normālu endometriju un endometrija vēzi (EK), pamatojoties uz PCDHGB731.UCOM ir unikāli ļaundabīgiem bojājumiem datu bāzēs un klīniskajos paraugos.No pacienta viedokļa unikālie UCOM samazina slieksni, lai izprastu dažādu sliktas veiktspējas nestabilu biomarķieru sarežģītās indikācijas un atbilstošo trauksmi novērtēšanas procesa laikā.Klīnicista skatījumā unikālie UCOM atšķir ļaundabīgus audzējus no labdabīgiem bojājumiem, kas palīdz pacientu šķirošanā un samazina nevajadzīgas medicīniskās procedūras un pārmērīgu ārstēšanu.Tāpēc unikālie UCOM samazina medicīniskās sistēmas dublēšanos, mazina sistēmas traucējumus un padara pieejamus vairāk medicīnisko resursu tiem, kam tā nepieciešama.
1. attēls. GPS darbplūsmas shēma DNS metilēšanas noteikšanai25.Pelēkā līnija: ievades DNS secība;sarkanā līnija: DNS, kas apstrādāta ar T4 DNS polimerāzi, aizstājot citozīnu ar 5′-metilcitozīnu ievades 3′ galā;zils C ar Me: metilēts citozīns;zils C: nemetilēts citozīns;dzeltens T: timīns25.
Visu vai neko
UCOM atrodas tikai vēža šūnās un tiek stabili konstatēti gandrīz visās vēža šūnās.Tika apstiprināts, ka HIST1H4F ir hipermetilēts gandrīz visos audzēju veidos, bet ne normālos paraugos27.Tāpat ir pierādīts, ka PCDHGB7 un SIX6 ir hipermetilēti visos audzēju paraugos, bet ne normālos paraugos30-32.Šis unikālais raksturlielums ievērojami uzlabo UCOM veiktspēju attiecībā uz noteikšanas un jutīguma robežu.Paraugos var diferencēt tikai 2% vēža šūnu, padarot UCOM par daudz jutīgāku biomarķieri nekā lielākā daļa esošo biomarķieru30. Kā biomarķieris, ko izmanto kolorektālā vēža noteikšanai, KRAS mutācijas pastāv tikai aptuveni 36% kolorektālā vēža gadījumu. kas liecina par sliktu diagnostikas potenciālu33.Zemā KRAS mutāciju izplatība kolorektālā vēža gadījumā ierobežo KRAS kombināciju ar citiem biomarķieriem.Faktiski biomarķieru kombinācija sākotnēji varētu šķist daudzsološa, taču ne vienmēr rada apmierinošu rezultātu, vienlaikus parādot daudz lielāku troksni noteikšanas analīzē un parasti ietver sarežģītākas eksperimentālās procedūras.Turpretī PCDHGB7 un citi UCOM pastāv visos vēža veidos.UCOM atklāj vēža komponentus dažāda veida vēža paraugos ar vislielāko precizitāti, vienlaikus izskaužot sarežģītus trokšņu slāpēšanas analīzes procesus.Nav grūti atklāt vēzi bagātīgā paraugā, taču ir ārkārtīgi grūti atklāt vēzi nelielā paraugā.UCOM spēj atklāt nelielu vēža daudzumu.
2. attēls UCOM raksturojums.
Vēža noteikšana pirms patoloģiskām izmaiņām
UCOM var noteikt pirmsvēža stadijā pirms patoloģiskām izmaiņām.Kā epiģenētiski biomarķieri, UCOM anomālijas rodas agrākā stadijā nekā fenotipiskās anomālijas, un tās ir nosakāmas visā audzēja ģenēzes, progresēšanas un metastāžu laikā34, 35.UCOM jutīgums laika gaitā uzlabo UCOM veiktspēju agrīnas stadijas vēža un pirmsvēža bojājumu noteikšanā.Agrīna vēža noteikšana, pamatojoties uz biopsijām un citoloģiju, var būt sarežģīta pat vispieredzējušākajiem patologiem.Viena biopsija, kas iegūta ar kolposkopiju, ir bijusi pozitīva 60,6% HSIL+ paraugu.Vairāku bojājumu gadījumā ir nepieciešamas papildu biopsijas, lai palielinātu jutību36.Turpretim UCOM, PCDHGB7, HSIL+ paraugu jutīgums ir 82%, kas pārsniedz biopsiju un vairuma biomarķieru jutību30.Metilēšanas marķierim FAM19A4 ir 69% jutība pret CIN2+, kas ir līdzīga citoloģijai, bet nevar atšķirt CIN1 no normāliem paraugiem37.Ir pierādīts, ka UCOM ir daudz jutīgāks agrīnas noteikšanas biomarķieris.Salīdzinot ar patologiem, kas balstīti uz pieredzi, UCOM ir augstāka noteikšanas jutība agrīnās stadijas vēža gadījumā, kas savukārt veicina vēža prognozes un izdzīvošanas uzlabošanos30.Turklāt UCOM piedāvā noteikšanas platformu, kas ir pieejama apgabaliem, kur trūkst pieredzējušu patologu, un ievērojami uzlabo noteikšanas efektivitāti.Ar vienotām paraugu ņemšanas un noteikšanas procedūrām UCOM noteikšana nodrošina stabilus un viegli interpretējamus rezultātus, kas labāk atbilst skrīninga protokolam, kam nepieciešams mazāk profesionāla personāla un medicīnas resursu.
Viegli atklāt
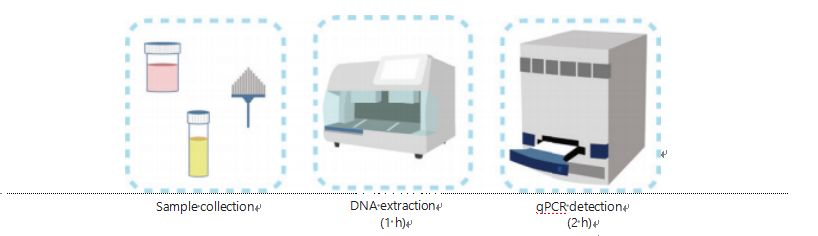
Pašreizējās metodes DNS metilēšanas noteikšanai ir sarežģītas un laikietilpīgas.Lielākajai daļai metožu nepieciešama bisulfīta transformācija, kas izraisa parauga kvalitātes zudumu un, iespējams, rada nestabilus un neprecīzus rezultātus.Sliktā reproducējamība, ko izraisa ārstēšana ar bisulfītu, potenciāli rada neskaidrības ārstiem un pacientiem un vēl vairāk traucē novērošanas un/vai ārstēšanas stratēģijas.Tāpēc mēs vēl vairāk modificējām UCOM noteikšanas metodi, lai izvairītos no problemātiskas paraugu apstrādes ar bisulfītu, pielāgotos klīniskās lietošanas prasībām un uzlabotu pieejamību.Mēs izstrādājām jaunu metodi, izmantojot metilēšanas jutīgus restrikcijas enzīmus apvienojumā ar reāllaika fluorescējošu kvantitatīvo PCR (Me-qPCR), lai kvantitatīvi noteiktu UCOM metilēšanas statusu 3 stundu laikā, izmantojot vienkāršas apstrādes procedūras (3. attēls).Me-qPCR var uzņemt vairākus paraugu veidus, piemēram, ķermeņa šķidrumu klīnisko savākšanu un pašu savāktus urīna paraugus.Savāktos klīniskos paraugus var apstrādāt, uzglabāt un viegli noteikt, izmantojot standartizētu un automatizētu DNS ekstrakciju.Pēc tam ekstrahēto DNS var tieši pielietot Me-qPCR platformai, lai iegūtu viena katla reakciju un izejas kvantitatīvās noteikšanas rezultātus.Pēc vienkāršas rezultātu analīzes, izmantojot diagnostikas modeļus, kas pielāgoti un apstiprināti konkrētiem vēža veidiem, UCOM noteikšanas rezultātu galīgā noteikšana tiek interpretēta un parādīta kā daļēji kvantitatīvā vērtība.Me-qPCR platforma pārspēj tradicionālo bisulfīta-pirozes noteikšanu UCOM noteikšanā, vienlaikus ietaupot 3 h bisulfīta konversiju saskaņā ar EZ DNA Methylation-Gold komplekta protokolu.Novatoriskā metilēšanas noteikšanas platforma padara UCOM noteikšanu stabilāku, precīzāku un pieejamāku30.
3. attēls UCOM noteikšanas process.Paraugu veidi ir profesionāli ņemti BALF, Pap birste un/vai pašu savākts urīns.DNS ekstrakcijas procesu var pielāgot automātiskajam ekstraktoram, kura produktu var tieši noteikt ar qPCR.
UCOM pielietojums
Plaušu vēzis
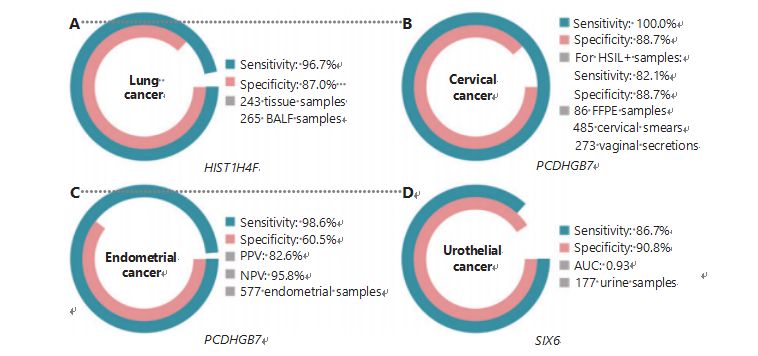
Plaušu vēzis ir otrs biežāk diagnosticētais un letālākais vēzis pasaulē, veidojot 11,4% no jauniem gadījumiem un 18,0% no jauniem nāves gadījumiem1.No visām diagnozēm 85% ir nesīkšūnu plaušu vēzis (NSCLC) un 15% ir sīkšūnu plaušu vēzis (SCLC), kam ir augstāks ļaundabīgo audzēju līmenis38.Zemas devas datortomogrāfijas (LDCT) skenēšana ir pašlaik ieteicamā plaušu vēža skrīninga metode, un ir pierādīts, ka tā uzlabo agrīnu atklāšanu un samazina mirstību6;tomēr zemās specifikas un sliktās pieejamības dēļ LDCT vēl ir jākalpo kā apmierinoša skrīninga metode, tāpat kā citi izplatīti vēža marķieri, piemēram, CEA39.LDCT skrīninga stratēģijas izmaksas un iespējamās nepareizas diagnozes un nepareizas diagnozes kavē plaušu vēža skrīninga veicināšanas progresu40.HIST1H4F, UCOM, ir milzīgs potenciāls kā agrīnas noteikšanas biomarķieris bronhoalveolārā šķidruma (BALF) paraugos27.HIST1H4F ir hipermetilēts plaušu adenokarcinomas un plaušu plakanšūnu karcinomas gadījumā ar noteikšanas specifiku 96, 7% un jutīgumu 87, 0% (4.A attēls) un izcilu veiktspēju I stadijas vēža gadījumā27.HIST1H4F specifiskums ir 96,5% un jutība 85,4% attiecībā uz NSCLC un attiecīgi 96,5% un 95,7% attiecībā uz SCLC27.Turklāt astoņu citu vēža veidu, tostarp aizkuņģa dziedzera un kolorektālā vēža, paraugi ir apstiprinājuši, ka HIST1H4F ir hipermetilēts visos astoņos veidos27.
Dzemdes kakla vēzis
Dzemdes kakla vēzis 2020. gadā bija ceturtais biežāk diagnosticētais vēzis un ceturtais galvenais vēža izraisīto nāves gadījumu cēlonis sievietēm 2020. gadā, veidojot 3,1 % no jauniem saslimšanas gadījumiem un 3,4 % ar vēzi saistīto nāves gadījumu visā pasaulē1.Lai līdz 2030. gadam izskaustu dzemdes kakla vēzi, kā to ierosinājusi PVO, agrīna dzemdes kakla vēža atklāšana ir nepieciešamība.Ja to konstatē agrīnā stadijā, 5 gadu dzīvildze sasniedz 92% ar invazīvu dzemdes kakla vēzi41.Amerikas vēža biedrības (ACS) vadlīnijas iesaka veikt dzemdes kakla citoloģijas testus, primāros HPV testus vai skrīninga testus42.Dzemdes kakla citoloģija ir invazīva un var noteikt tikai 63,5% CIN2+ gadījumu37.
Turpretim PCDHGB7 ir strādājis daudz labāk, izmantojot Pap uztriepes un maksts sekrēcijas, un var efektīvi atšķirt HSIL no LSIL ļoti agrīnā stadijā.PCDHGB7 vien jutība pret dzemdes kakla vēzi ir 100,0% un specifiskums 88,7% (attēls 4B), un HSIL+ paraugiem ir 82,1% jutība un 88,7% specifiskums30.PCDHGB7 ir arī 90,9% jutība un 90,4% specifiskums dzemdes kakla vēža maksts sekrēcijas paraugos, kurus ir daudz vieglāk savākt30.Kombinācijā ar augsta riska (hr) HPV testu vai Thinprep citoloģijas testu (TCT), PCDHGB7 ir paaugstināta jutība par 95,7% un specifiskums par 96,2%, ievērojami pārsniedzot hrHPV testu (20,3%), TCT (51,2%). ), un abi kopā (57,8%) dzemdes kakla vēža gadījumā30.Ir arī pierādīts, ka PCDHGB7 ir hipermetilēts 17 vēža veidos no TCGA datu bāzes, norādot uz tā piemērotību UCOM saimei30.
4. attēls UCOM ir apstiprināti četros vēža veidos liela mēroga klīniskos pētījumos.A. HIST1H4F, UCOM, veiktspēja plaušu vēža noteikšanā 508 paraugiem.B. PCDHGB7, UCOM, veiktspēja dzemdes kakla vēža noteikšanā 844 paraugos.C. PCDHGB7, UCOM, veiktspēja endometrija vēža noteikšanā 577 endometrija Pap un Tao suku paraugiem.D. SIX6, UCOM, veiktspēja urotēlija vēža noteikšanā 177 paraugos.
EC
EK ir viens no visizplatītākajiem sieviešu reproduktīvās sistēmas vēža gadījumiem visā pasaulē, un tiek lēsts, ka katru gadu tiek reģistrēti 4,2 miljoni jaunu gadījumu un 1% ar vēzi saistīto nāves gadījumu1.Ar veiksmīgu diagnozi agrīnā stadijā EK ir izārstējama, un I stadijas vēža gadījumā 5 gadu izdzīvošanas rādītājs ir 95%.Pacienti, kuriem ir simptomi, piemēram, patoloģiska dzemdes asiņošana, saņem periodisku klīnisku novērtējumu un tiek pakļautas invazīvas un sāpīgas biopsijas procedūras, lai gan tikai 5–10 % pacientu galu galā attīstās EC43.Transvaginālā ultraskaņa kā izplatītā noteikšanas metode ir ļoti neuzticama, jo tā nespēj atšķirt labdabīgas endometrija izmaiņas no ļaundabīgām un augstu viltus pozitīvo rezultātu44.
Tika veikts paralēls seruma CA-125, plaši ieviesta EK biomarķiera, un PCDHGB7 salīdzinājums.Seruma CA-125 jutība bija 24,8%, kas liecina, ka CA-125 ir nepietiekams EK marķieris, neskatoties uz specifiskumu 92,3%31.PCDHGB7 noteikšana, izmantojot Pap otu paraugus, ECatall posmos nodrošināja 80,65% jutību un 82,81% specifiskumu, savukārt Tao sukas jutīgums bija 61,29% un specifiskums 95,31%31.PCDHGB7 diagnostikas modelis, kas balstīts uz Me-qPCR, nodrošināja 98,61% jutību, 60,5% specifiskumu un 85,5% kopējo precizitāti, izmantojot Pap un Tao suku paraugus (4.C attēls)31.
Urotēlija vēzis
Urotēlija vēzis, kas sastāv no urīnpūšļa, nieru iegurņa un urīnizvadkanāla vēža, bija septītais biežāk diagnosticētais vēzis 2020. gadā visā pasaulē, izraisot 5,2% jaunu gadījumu un 3,9% nāves gadījumu1.Urotēlija vēzis, no kuriem vairāk nekā 50% ir urīnpūšļa vēzis, bija ceturtais visbiežāk diagnosticētais vēzis Amerikas Savienotajās Valstīs 2022. gadā, veidojot 11,6% no jaunatklātajiem gadījumiem3.Aptuveni 75% urīnpūšļa vēža tiek klasificēti kā ne-invazīvs urīnpūšļa vēzis, kas attiecas tikai uz gļotādu vai submucosa45.Cistoskopijas biopsija ir zelta standarts urotēlija vēža diagnosticēšanai, ko īsteno ar fluorescences in situ hibridizāciju (FISH) un citoloģijas testiem.FISH un citoloģijai ir vāja diagnostikas veiktspēja, un cistoskopija ir uzmācīga, un tās pamatā ir risks, ka iztrūks mikrobojājumi, bojājumi tiek nepareizi interpretēti un, iespējams, var izraisīt vēža izplatīšanos vai recidīvu46.Tika pierādīts, ka iepriekš apstiprinātais UCOM, PCDHGB7, ir hipermetilēts urotēlija vēža gadījumā ar laukumu zem līknes 0, 86, kas liecina par iespējamu diagnostikas spēju30.Lai vēl vairāk apstiprinātu vairāk UCOM un labāk pielāgotu vairāk paraugu veidu, tika pārbaudīts SIX6, jauns UCOM, un tas parādīja lielisku diagnostikas potenciālu agrīnā urotēlija vēža noteikšanā, izmantojot urīna paraugus Me-qPCR platformā.SIX6 noteikšana, izmantojot urīna paraugus, uzrādīja konkurētspējīgu jutību 86,7% un specifiskumu 90,8% (attēls 4D), vienlaikus neinvazīvu un viegli iegūstamu32.Pašlaik tiek pētīts SIX6 potenciāls metastāžu uzraudzībā un ārstēšanas efektivitātes novērtēšanā.
Nākotne un izaicinājumi
UCOM ir spēcīga veiktspēja vairāku vēža diagnostikas potenciālā, taču vēl ir daudz darāmā.Mēs esam paplašinājuši UCOM sarakstu un aktīvi apstiprinājuši UCOM vairākos vēža veidos, tostarp tajos, kurus tradicionāli ir grūti noteikt.Validācijas rezultāti no TCGA datu bāzēm ir vēl vairāk apstiprinājuši UCOM pielietojumu vairākos vēža veidos un vairākās situācijās.Sākotnējā izmeklēšanā ir pierādīts, ka UCOM ir spēcīgs holangiokarcinomu un aizkuņģa dziedzera adenokarcinomu diagnostikas potenciāls, ko gandrīz neiespējami diagnosticēt agrīnā stadijā ar pašreizējām skrīninga metodēm32, 47.Spēju noteikt retus vēža veidus ar UCOM var izmantot ar cirkulējošo audzēja DNS (ctDNS), izmantojot uzlabotu šķidrās biopsijas platformu48.Pētījumā, kurā piedalījās uz plazmas DNS balstīts pan-vēža noteikšanas panelis, tika iegūts 57,9% jutīgums49.Neskatoties uz augsto specifiku, kopējais sniegums atklāj, ka vēl ir kur uzlabot.
UCOM unikālās īpašības ir arī atbalstījušas UCOM potenciāla izpēti ārstēšanas efektivitātes novērtēšanā un atkārtošanās uzraudzībā.Saskaņā ar reakcijas novērtēšanas kritērijiem cietos audzējos (RECIST) medicīniskā attēlveidošana ir ieteicamā metodika recidīvu uzraudzībai un ārstēšanas efektivitātes novērtēšanai, savukārt audzēju marķierus izmanto atsevišķi50.Tomēr patiesībā attēlveidošanas pieejas lielā mērā ietekmē biežums un laiks, un tāpēc pacienti tiek pakļauti lielākam riskam un izmaksām51,52.SIX6 ir apstiprināts, lai tas kalpotu kā krūts vēža metastāžu prognozētājs32.Uz šķidro biopsiju balstīta ctDNS uzraudzība nodrošina reāllaika uzraudzību minimālos atlikušos slimības mēnešus pirms radioloģiskās noteikšanas, ideālā gadījumā aizkavējot un novēršot ar recidīvu saistītu vēža progresēšanu53.Sākotnējie rezultāti liecina, ka UCOM atspoguļo vēža hipermetilācijas līmeni reāllaikā tūlīt pēc operācijas un ārstēšanas32.Augstā UCOM jutība un pielietojamība vairākos neuzbāzīgos paraugu tipos ļauj UCOM kalpot kā precīzs atkārtošanās uzraudzības biomarķieris, vienlaikus saglabājot augstu pacienta atbilstību.
Tajā pašā laikā publiska pieejamība pārbaudei ir vēl viens svarīgs jautājums, kas prasa papildu pūles.Lai gan UCOM noteikšanas sadarbība ir pieņemta vairākās slimnīcās, cerot gūt labumu lielākam skaitam pacientu, pro bono noteikšana un skrīnings ir aktīvi veikti Ķīnas laukos.UCOM ir nepieciešama uzlabota pieejamība, lai tos varētu kvalificēt kā iespējamu skrīninga rīku, īpaši mazattīstītos apgabalos.
Lai gan UCOM lietojumprogrammas agrīnās noteikšanas rezultāti ir daudzsološi, par UCOM pastāv daudz nezināmo.Ar aktīvu izpēti ir nepieciešami papildu pētījumi par to, kāpēc UCOM ir vispārēji sastopami vēža gadījumos.Pamatā esošie epiģenētiskie regulēšanas mehānismi, kas ir UCOM pamatā, ir vērti turpmākai izmeklēšanai, kas varētu attaisnot jaunu virzienu vēža terapijai.Atgriežoties pie mijiedarbības starp audzēja viendabīgumu un neviendabīgumu, mēs esam ieinteresēti, kāpēc UCOM var būt izņēmums lielākajai daļai vēža biomarķieru, kas ir cieši saistīti ar konkrētiem vēža veidiem.UCOM identificēto DNS metilēšanas aberāciju loma audzēja veidošanā, audzēja progresēšanā un metastāzēs nav noteikta šūnu identitātes zaudēšanas un atgūšanas procesā, un tādēļ ir nepieciešama rūpīga pārbaude.Vēl viena liela interese ir UCOM viendabīguma iezīmes iekļaušana ar audu unikāliem marķieriem, cerot tuvoties precīzai vēža pēdu noteikšanai un audzēja audu izcelsmes noteikšanai apgrieztā veidā.UCOM var būt ideāls līdzeklis vēža profilaksei, vēža noteikšanai un potenciāli vēža aizsardzībai un likvidēšanai.
Piešķirt atbalstu
Šo darbu atbalstīja Ķīnas Nacionālā galvenā pētniecības un attīstības programma (granta Nr. 2022BEG01003), Ķīnas Nacionālais dabaszinātņu fonds (granta Nr. 32270645 un 32000505), Heilongdzjanas provinces veselības komisijas dotācija (dotācijas Nr. 2020-111). , un Heze Zinātnes un tehnoloģiju institūta dotācija (granta Nr. 2021KJPT07).
Paziņojums par interešu konfliktu
Vejs Li ir Shanghai Epiprobe Biotechnology Co., Ltd. pētniecības un attīstības direktors. Wenqiang Yu darbojas Epiprobe Zinātniskajā konsultatīvajā padomē.W. Yu un Epiprobe ir apstiprinājuši neapstiprinātos patentus, kas saistīti ar šo darbu.Visi pārējie autori nedeklarē nekādas konkurējošas intereses.
Autoru ieguldījums
Projektu izstrādāja un izstrādāja: Chengchen Qian un Wenqiang Yu.
Uzrakstīja darbu: Chengchen Qian.
Izgatavoja ilustrācijas: Chengchen Qian.
Pārskatīja un rediģēja manuskriptu: Xiaolong Zou, Wei Li, Yinshan Li un Wenqiang Yu.
Atsauces
1. Sung H, Ferlay J, Siegel RL, LaversanneM, Soerjomataram I, Jemal A u.c.Globālā vēža statistika 2020: GLOBOCAN aprēķini par
saslimstība un mirstība visā pasaulē 36 vēža gadījumiem 185 valstīs.CA Cancer J Clin.2021. gads;71: 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S u.c.Vēža statistika Ķīnā un ASV, 2022: profili, tendences un noteicošie faktori.Chin MedJ (angļu valoda).2022. gads;135: 584-90.
3. Siegel RL, Miller KD, WagleNS, JemalA.Vēža statistika, 2023. CA Cancer J Clin.2023. gads;73: 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M u.c.Agrīna vēža atklāšana.Zinātne.2022. gads;375: eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.Stratēģijas priekš
kolorektālā vēža skrīnings.Gastroenteroloģija.2020. gads;158: 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.Plaušu vēža skrīnings.Am J Respir Crit Care Med.2015. gads;191: 19-33.
7. Bouvard V, WentzensenN, Mackie A, Berkhof J, BrothertonJ, Giorgi-Rossi P u.c.IARC perspektīva dzemdes kakla vēža skrīningam.N EnglJ Med.2021. gads;385: 1908-18.
8. Xue P, Ng MTA, QiaoY.Kolposkopijas izaicinājumi dzemdes kakla vēža skrīningam LMIC un mākslīgā intelekta risinājumi.BMC Med.2020. gads;18: 169.
9. Johnson P, Zhou Q, Dao DY, Lo YMD.Cirkulējošie biomarķieri hepatocelulārās karcinomas diagnostikā un ārstēšanā.Nat Rev Gastroenterol Hepatol.2022. gads;19: 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Seruma PSA balstīta agrīna prostatas vēža noteikšana Eiropā un pasaulē: pagātne, tagadne un nākotne.Nats Revs Urols.2022. gads;19:
562-72.
11. HolyoakeA, O'Salivan P, Pollock R, Best T, Watanabe J, KajitaY,
un citi.Multipleksa RNS urīna testa izstrāde urīnpūšļa pārejas šūnu karcinomas noteikšanai un stratifikācijai.Clin Cancer Res.2008. gads;14: 742-9.
12. Feinberg AP, Vogelstein B. Hipometilācija atšķir dažu cilvēka vēža veidu gēnus no to parastajiem līdziniekiem.Daba.1983. gads;301: 89-92.
13. Ng JM, Yu J. Promoter hypermethylation of tumor supressor gēnu kā potenciālo biomarķieri kolorektālā vēža.IntJ Mol Sci.2015. gads;16: 2472-96.
14. Esteller M. Vēža epigenomika: DNS metilomi un histonu modifikācijas kartes.Nats Revs Ženē.2007. gads;8: 286-98.
15. Nishiyama A, Nakanishi M. Navigācija DNS metilēšanas ainavā vēža.Trends Genet.2021. gads;37: 1012-27.
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P u.c.Cilvēka embriju cilmes šūnu daudzrindu diferenciācijas epigenomiskā analīze.Šūna.2013. gads;153: 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X u.c.Genoma mēroga analīzes atklāj Polycomb lomu DNS metilēšanas ieleju hipometilācijas veicināšanā.Genoms Biol.2018. gads;19:18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
un citi.DNS metilēšanas analīze vēža gadījumā: pārskatīta vieta.Nat Rev Clin Oncol.2018. gads;15: 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D u.c.Mērķtiecīga, uz metilēšanu balstīta vairāku vēža agrīnas noteikšanas testa klīniska validācija, izmantojot neatkarīgu validācijas komplektu.Ann Oncol.2021. gads;32: 1167-77.
20. Hanahan D, Veinberga, RA.Vēža pazīmes.Šūna.2000;100: 57-70.
21. Hanahan D. Vēža pazīmes: jaunas dimensijas.Vēža disks.2022. gads;12: 31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. Precizitātes onkoloģija: kas, kā, kas, kad un kad nē?Am Soc Clin Oncol izglītības grāmata.2017: 160-9.
23. Liu H, Meng X, Wang J. Reāllaika kvantitatīvā metilēšana
PAX1 gēna noteikšana dzemdes kakla vēža skrīningā.IntJ ginekola vēzis.2020. gads;30: 1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP u.c.Vairāku mērķu DNS pārbaude kolorektālā vēža skrīningam.N EnglJ Med.2014. gads;370: 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S u.c.Vadītāja pozicionēšana
sekvencēšana identificē novirzes DNS metilēšanas modeļus, kas maina šūnu identitāti un audzēja imūnās uzraudzības tīklus.Genoms
Res.2019. gads;29: 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY u.c.Neuzbāzīga vairāku vēža noteikšana, izmantojot cirkulējošu DNS metilēšanas sekvencēšanu bez šūnām (THUNDER): izstrādes un neatkarīgi validācijas pētījumi.Ann Oncol.2023. gads;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B u.c.Ar histonu saistītie gēni ir hipermetilēti plaušu vēža gadījumā un hipermetilēti
HIST1H4F varētu kalpot kā visas vēža biomarķieris.Cancer Res.2019. gads;79: 6101-12.
28. HeijnsdijkEA, Wever EM, AuvinenA, Hugosson J, Ciatto S, Nelen V u.c.Prostatas specifiskā antigēna skrīninga ietekme uz dzīves kvalitāti.N EnglJ Med.2012. gads;367: 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. Vēža skrīninga biomarķieru testu klīniskā efektivitāte, kas tiek piedāvāti kā pašapmaksāts veselības pakalpojums: sistemātisks pārskats.Eur J Sabiedrības veselība.2016. gads;26: 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z u.c.
Hipermetilēts PCDHGB7 kā universāls tikai vēža marķieris un tā pielietojums agrīnā dzemdes kakla vēža skrīningā.Clin Transl Med.2021. gads;11: e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X u.c.Hipermetilēts PCDHGB7 kā biomarķieris agrīnai endometrija vēža noteikšanai endometrija suku paraugos un dzemdes kakla skrāpējumos.Priekšējais Mol Biosci.2022. gads;8: 774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F u.c.Savstarpēji
ekskluzīva epiģenētiskā modifikācija SIX6 ar hipermetilāciju pirmsvēža stadijas un metastāžu rašanās izsekošanas nolūkā.Signal Transduct Target Ther.2022. gads;7: 208.
33. Huang L, Guo Z, Wang F, Fu L. KRAS mutācija: no neārstējamas līdz medikamentiem vēža gadījumā.Signal Transduct Target Ther.2021. gads;6: 386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE u.c.P16 (INK4a) novirzes metilēšana ir agrīns notikums plaušu vēža gadījumā un potenciāls biomarķieris agrīnai diagnostikai.Proc Natl Acad Sci U SA.1998. gads;95: 11891-6.
35. Robertsons KD.DNS metilēšana un cilvēka slimības.Nats Revs Ženē.2005. gads;6: 597-610.
36. Wentzensen N, Walker JL, Gold MA, Smith KM, ZunaRE,
Mathews C, et al.Vairākas biopsijas un dzemdes kakla vēža prekursoru noteikšana kolposkopijā.J Clin Oncol.2015. gads;33: 83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD u.c.FAM19A4 metilēšanas analīze
gēns dzemdes kakla skrāpējumos ir ļoti efektīvs dzemdes kakla noteikšanā
karcinomas un progresējoši CIN2/3 bojājumi.Cancer Prev Res (Phila).2014. gads;7: 1251-7.
38. Thai AA, Solomon BJ, Sequist LV, Gainor JF, Heist RS.Plaušu vēzis.Lancete.2021. gads;398: 535-54.
39. Grunnet M, Sorensen JB.Karcinoembrionālais antigēns (CEA) kā audzēja marķieris plaušu vēža gadījumā.Plaušu vēzis.2012. gads;76: 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L u.c.Plaušu vēža skrīnings, 3.2018. gada versija, NCCN klīniskās prakses vadlīnijas onkoloģijā.J Natl Compr Canc Netw.2018. gads;16: 412-41.
41. Amerikas vēža biedrība.Fakti un skaitļi par vēzi.Atlanta, GA, ASV: Amerikas vēža biedrība;2023. gads [atjaunots 2023. gada 1. martā;citēts 2023. gada 22. augusts].
42. FonthamETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
Hercigs A un citi.Dzemdes kakla vēža skrīnings personām ar vidējo risku: 2020. gada vadlīniju atjauninājums no Amerikas vēža biedrības.CA Cancer J Clin.2020. gads;70: 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. Endometrija vēža riska saistība ar asiņošanu sievietēm pēcmenopauzes periodā: sistemātisks pārskats un metaanalīze.JAMA Intern Med.2018. gads;178: 1210-22.
44. Džeikobss I, Džentrijs Maharadžs A., Bērnels M, Mančandra, Sings N,
Sharma A, et al.Transvaginālās ultraskaņas skrīninga jutība
endometrija vēža gadījumā sievietēm pēcmenopauzes periodā: gadījuma kontroles pētījums UKCTOCS kohortā.Lancet Oncol.2011. gads;12: 38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
PalouJ, et al.Eiropas Uroloģijas asociācijas vadlīnijas par ne-muskuļos invazīvu urīnpūšļa vēzi (TaT1 un karcinomu in situ) -
2019. gada atjauninājums.Eur Urol.2019. gads;76: 639-57.
46. Aragon-Ching JB.Izaicinājumi un sasniegumi urotēlija augšējā trakta un urīnpūšļa karcinomu diagnostikā, bioloģijā un ārstēšanā.Urols Oncol.2017. gads;35: 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
Holangiokarcinoma – attīstās koncepcijas un terapeitiskās stratēģijas.Nat Rev Clin Oncol.2018. gads;15: 95-111.
48. Ye Q, Ling S, Zheng S, Xu X. Šķidruma biopsija hepatocelulārā
karcinoma: cirkulējošās audzēja šūnas un cirkulējošā audzēja DNS.Mols vēzis.2019. gads;18: 114.
49. Džans Y, Jao Y, Sju Y, Li L, Gong Y, Džans K u.c.Pan-vēzis
cirkulējošā audzēja DNS noteikšana vairāk nekā 10 000 ķīniešu pacientu.Nat Commun.2021. gads;12:11.
50. Eisenhauer EA, Therasse P, BogaertsJ, Schwartz LH, Sargent D, Ford R u.c.Jauni atbildes reakcijas novērtēšanas kritēriji cieto audzēju gadījumā: pārskatīta RECIST vadlīnija (versija 1.1).Eur J Vēzis.2009. gads;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST - mācīšanās no pagātnes, lai veidotu nākotni.Nat Rev Clin Oncol.
2017. gads;14: 187-92.
52. Seymour L, BogaertsJ, Perrone A, FordR, Schwartz LH, Mandrekar S u.c.iRECIST: vadlīnijas atbildes kritērijiem lietošanai izmēģinājumos
imūnterapijas testēšana.Lancet Oncol.2017. gads;18: e143-52.
53. PantelK, Alix-Panabières C. Šķidruma biopsija un minimālā atlikušā slimība – jaunākie sasniegumi un ietekme uz ārstēšanu.Nat Rev Clin Oncol.2019. gads;16: 409-24.
Citējiet šo rakstu kā: Qian C, Zou X, Li W, Li Y, Yu W. Priekšpostenis pret vēzi: universālie tikai vēža marķieri.Cancer Biol Med.2023. gads;20: 806-815.
doi: 10.20892/j.issn.2095-3941.2023.0313
Ievietošanas laiks: 07.07.2024